Figura 1
Modelos neuropsicológicos y neuroimagen de las alteraciones cerebrales ocasionadas por la cocaína
0 commentsPosted in Artículos | Vol. 6 | Núm. 2 | 2020
| Autor(es) | Nelly Julia Borda Riveros |
| Contacto | nellyborda3@gmail.com |
| Tipo de Contribución | Revisión de la literatura |
| Referencia | Revista Digital Internacional de Psicología y Ciencia Social Vol. 6, Núm. 2, 2020. |
RESUMEN
La presente revisión de literatura hace referencia a los modelos que la neuropsicología manifiesta en relación a la drogodependencia, con el propósito de explicar el origen y desarrollo de los trastornos adictivos, respaldados por medio de la neuroimagen. El modelo clásico de la adicción, propuesto por Wikel (1965), el cual fue reformulado por nuevos modelos, entre los más destacados, el modelo basado en la transición entre impulsividad y compulsión de Everitt y Robbins (2005), el modelo de alostasis y estrés de Koob y Le Moal (2001, 2008), y el modelo de la sensibilización al incentivo de Robinson y Berridge (2001, 2003, 2008). De manera alternativa surgió el modelo (I-RISA) de Goldstein y Volkow (2002). Al final se formuló el modelo somático de las drogodependencias propuesto por Verdejo-García y Bechara (2009) y Pérez-García y Bechara (2006). Por último se aborda la recuperación o rehabilitación de la adicción desde una perspectiva neurológica y neuropsicológica.
Palabras Clave: modelos neuropsicologicos, neuroimagen, cocaína, evaluación, rehabilitación.
ABSTRACT
The present literature review refers to the models that neuropsychology manifests in relation to drug dependence, in order to explain the origin and development of addictive disorders, supported by neuroimaging. The classic addiction model, proposed by Wikel (1965), which was reformulated by new models, among the most prominent ones, the model based on the transition be-tween impulsivity and compulsion from Everitt and Robbins (2005), the model of allostasis and stress by Koob and Le Moal (2001, 2008) and the Robinson and Berridge (2001, 2003, 2008) incentive sensitization model. Alternatively, the Goldstein and Volkow (2002) model (I-RISA) emerged. Finally, the somatic model of drug dependencies was formulated, proposed by Verdejo-García and Bechara (2009) and Pérez-García and Bechara (2006). Finally, the recovery or rehabilitation of addiction is addressed from a neurological and neuropsychological perspective.
Keywords: neuropsychological models, neuroimaging, cocaine, evaluation, rehabilitation.
INTRODUCCIÓN
El consumo de cocaína es un problema de interés mundial, porque además de ser una de las drogas más cotizadas, es un opiáceo que afecta de modo directo al cerebro. Múltiples estudios aseguran que su con-sumo se asocia con alteraciones estructurales y funciona-les del cerebro, sobre todo de la corteza frontal (Ambro-sio-Flores y Fernández-Espejo, 2011; García-Fernández, García-Rodríguez, Secades-Villa, Fernández-Hermida y Sánchez-Hervás, 2010; Lorea, Fernández-Montalvo, Ti-rapu-Ustarroz, Landa y López-Goñi, 2010; Verdejo, Pé-rez, Sánchez, Rodríguez y Gómez, 2007; Verdejo, Agui-lar de Arcos y Pérez, 2004). Además, que la cantidad, la frecuencia y la permanencia del consumo de cocaína se relacionan a un mayor número de déficits (Madoz-Gúr-pide, Ochoa-Mangado y Martínez-Pelegrín, 2009; Ma-doz-Gúrpide y Ochoa-Mangado, 2012; Ambrosio-Flores y Fernández-Espejo, 2011). Estas alteraciones se evidencian con fallos en las pruebas de rendimiento neuropsicológi-cas que evidencian la pérdida de funcionalidad que el pa-ciente experimenta en su vida cotidiana (Madoz-Gúrpide, Ochoa-Mangado y Martínez-Pelegrín, 2009).
Se han demostrado alteraciones tanto en las funciones cognitivas, y de manera clara en las funciones ejecutivas. Dichas repercusiones de daño cerebral son importantes tan-to en el funcionamiento cotidiano como en el propio proce-so adictivo y el pronóstico del tratamiento (Madoz-Gúrpide, Ochoa-Mangado y Martínez-Pelegrín, 2009).
Así pues, investigaciones previas indican que el consumo de sustancias psicoactivas está asociado con la presencia de alteraciones neuropsicológicas, como la memoria, la capacidad atencional o funciones eje-cutivas, ejerciendo sus efectos en una serie de sistemas cerebrales, además en el funcionamiento de diversos mecanismos emocionales, motivacionales, cognitivos y ejecutivos (Verdejo, 2006).
Además, con el respaldo de los estudios de neuroi-magen se ha demostrado que las áreas que compromete una drogodependencia son córtex frontal, estructuras límbicas (ínsula, amígdala e hipocampo) y ganglios ba-sales, predominantemente lateralizadas en el hemisferio derecho, por lo que hay una relación con estructuras implicadas en la valoración motivacional y emocional de reforzadores (amígdala e ínsula) y con alteraciones dopaminérgicas (Fagundo, Martín-Santos, Abanades, Farré y Verdejo García, 2007).
Así pues, enfocándose en una de las drogas ilegales más populares, la cocaína, de la cual —según datos esta-dísticos— su consumo durante la última década se apro-xima a los 14 millones de personas, donde 0.34% de la población mundial corresponde en personas de entre 15 y 64 años, demostrando por medio de múltiples estudios deterioros neuropsicológicos en sus consumidores, sobre todo en procesos de atención, concentración, memoria, habilidades psicomotoras, inhibición de respuesta, flexi-bilidad y toma de decisiones (Verdejo, 2006).
DESARROLLO TEÓRICO
Modelo clásico de la adicción
El funcionamiento de la droga como reforzador positivo
Se entiende por reforzamiento al proceso por el cual una respuesta tiene más probabilidad de producirse ante un estímulo, porque dicha respuesta tiene consecuencias fa-vorables para el sujeto. Para que esto suceda es necesario que haya determinados cambios en el Sistema Nervioso Central, que implican conexiones entre sistemas neuronales que regulan la percepción del estímulo y los que efectúan la respuesta (Vazquez y Ubach, 2018).
Por tanto, un reforzador positivo es el estímulo que hace que una respuesta aumente su probabilidad de pro-ducirse. Hay reforzadores naturales y artificiales; los pri-meros son los esenciales para la supervivencia, como la comida y el sexo; en cambio, los segundos se refieren a estímulos dispensables, como los videojuegos, las dro-gas y/o los juegos de azar. Ambos inciden en los sistemas neuronales, sólo que en el caso de los reforzadores artificiales hay una alteración, y por eso es que aparecen com-portamientos poco saludables que permanecen a pesar de las consecuencias adversas, desembocando a lo que se denomina adicción (Vazquez y Ubach, 2018).
Teniendo en cuenta dichos conceptos, desde un punto de vista conductual el modelo clásico de la adic-ción plantea que las drogas funcionan como reforzadores positivos, llevando a que la persona reitere o manten-ga su conducta cada vez que le cause placer o bienestar (Ambrosio-Flores y Fernández-Espejo, 2011).
Es así que las principales propiedades de regula-ción ante la autoadministración de drogas es que, pri-meramente, son reforzadores positivos; segundo, actúan como estímulos discriminativos internos y, por último, tienen propiedades aversivas. Las dos primeras facilitan las conductas de búsqueda, mientras que la última de- bilita el desarrollo y mantenimiento de las mismas (Am-brosio-Flores y Fernández-Espejo, 2011).
Una de las drogas con alto índice de comercio en el mundo, a pesar de ser ilegal, es la cocaína, la cual es un estimulante muy adictivo, elaborada con hojas de coca, provenientes de America del Sur (Ayala, Chicahual, Du-ffau y Vargas, 2019).
Ahmed y Koob (1998) así como Ahmed, Walker y Koob (2000) hicieron estudios experimentales con animales con los que utilizaron cocaína y una autoad-ministración prolongada de la droga como reforzador positivo, y obtuvieron como resultado el fenómeno de-nominado “escalada de la droga” (Soria, 2006). Dicho fenómeno hace referencia a que el animal requería un aumento de dosis para que hubiera un efecto; esto es-taría relacionado con la segregación de dopamina y sus receptores D1, D2. Los individuos adictos a la cocaína también tienen una menor liberación de dopamina que los individuos sanos, es decir, hay una baja activación del sistema dopaminérgico por refuerzos fisiológicos, y de esta manera el consumo de cocaína ayudaría a com-pensar este déficit (Soria, 2006).
Por otro lado, también es necesario indicar que los estímulos ambientales pueden ser estímulos condiciona-dos, es decir, que hay una asociación de estímulos que eran previamente neutrales con los efectos de drogas psi-coactivas, siendo reforzadores secundarios. Tal es el caso de los olores, sonidos, la gente y sensaciones que se evi-dencian durante el consumo y que predicen los efectos de la misma, siendo capaces de producir la sintomatolo-gía del síndrome de retirada o de los efectos placenteros. Es decir, hay una tolerancia y sensibilización cuando la droga es administrada siempre en el mismo entorno (Am-brosio-Flores y Fernández-Espejo, 2011).
Respecto a la cocaína, los estímulos condiciona-dos evocan sensaciones placenteras, es decir, que los cocainómanos, en cuanto ven a quien les proporcio-na la droga, comienzan a sentir sensaciones eufóricas aun cuando no la hayan probado todavía. Los estímu-los condicionados son demasiado fuertes a medida que progresa la dependencia; las personas van estrechando su repertorio conductual y tienden a hacer las cosas de manera estereotipada, siempre del mismo modo y con la misma gente, similar a pacientes obsesivos-compulsivos (Ambrosio-Flores y Fernández-Espejo, 2011).
Asimismo, los estímulos condicionados también ge-neran cambios metabólicos en determinadas áreas cere-brales. Esto se pudo observar usando la metodología de tomografía por emisión de positrones, donde se observa que los estímulos asociados al consumo de cocaína ge-neran un aumento significativo de flujo sanguíneo en áreas del sistema límbico, como la amígdala o la corteza cingulada. Además, en sujetos que tienen cocaína en su cuerpo se comprobó que se produce una disminución del metabolismo cerebral en numerosas regiones cere-brales, estriado dorsal, amígdala y corteza, y que dicho descenso metabólico no regresa a niveles normales sino hasta después de cuatro meses de abstinencia, similar a pacientes obsesivos-compulsivos (Ambrosio-Flores y Fernández-Espejo, 2011).
Sustratos neurales del reforzamiento
Dentro del sistema mesocorticolímbico —el cual está con-formado por estructuras cerebrales del cerebro medio (área tegmental ventral, sustancia negra, etcétera) y al cerebro anterior (cuerpo estriado, amígdala, tálamo, hipocampo, cortezas prefrontal y cingulada)— se efectúa la regulación de las sensaciones placenteras inducidas por reforzadores naturales y artificiales, razón por la cual se le denomina “circuito cerebral de la recompensa o del reforzamiento”; es un sustrato neural que mantiene las conductas adictivas (Corominas, Roncero, Bruguera y Casas, 2007).
En el consumo crónico de cocaína hay un desequili-brio de la función dopaminérgica, que hace que el sujeto repita el consumo con frecuencia para tener las mismas sensaciones que tuvo al comienzo del consumo; sin em-bargo esto es imposible. La razón principal es que la li-beración de dopamina es mucho menor o no se produce porque la dopamina modula la actividad neuronal me-diante dos grandes familias de receptores (D1 y D2), don-de al activar el neurotransmisor D1 se inician reacciones moleculares en la neurona. En cambio, al activar el D2 no se inician dichas reacciones; esto es, que el neurotrans-misor D1 está relacionado con la aparición del deseo, mientras que el D2 contribuye al mantenimiento de la conducta adictiva (Méndez-Díaz, Romero-Torres, Cor-tés-Morelos, Ruíz-Contreras y Prospéro-García, 2017).
Por otro lado, los receptores de dopamina D3 también están relacionados de modo especifico con las propiedades adictivas, sobre todo con el consumo de cocaína. Su locali-zación postsináptica está restringida al núcleo accumbens y la amígdala, donde actúan como autorreceptores, lo que ge-nera la búsqueda impulsiva de la sustancia ante un estímulo condicionado. Por lo que el D3 está estrechamente implica-do en la asociación entre el refuerzo y estimulo condiciona-do (Di Ciano, Underwood, Hagan y Everitt, 2003).
Es así que la dopamina no sólo es un neurotransmi-sor clave en las acciones reforzantes positivas de las dro-gas, sino que tiene una función anticipatoria del refuer-zo y que no interviene en el proceso de reforzamiento como tal. Esto se demostró mediante estudios por micro-diálisis y voltametría (Consejo Mexicano de Neurocien- cias, 2018), esto es, la dopamina tendría una función en las acciones reforzantes de las drogas sólo en la fase de anticipación al consumo, pero no en el consumo en sí (Ambrosio-Flores y Fernández-Espejo, 2011).
Esto mismo fue respaldado por el Consejo Mexicano de Neurociencias (2018), el cual afirma que estudios ex-perimentales en animales demostraron que la segregación de dopamina es anticipatoria al consumo de la sustancia. Es decir, los niveles de dopamina en el animal aumentan de inmediato antes de recibir la inyección y disminuyen después, y así de manera progresiva incrementándose hasta el momento de la siguiente inyección.
Por su parte, Kalivas, LaLumiere, Knackstedt y Shen (2009) indican que los estímulos ambientales condicio-nados causan una activación de la dopamina, la cual interviene en las fases anticipatorias del reforzamiento porque se sabe que dichos estímulos adquieren propie-dades reforzantes secundarias (incentivos de la conduc-ta) cuando se asocian con los reforzadores primarios.
Por otro lado, en el consumo crónico se producen neuroadaptaciones a largo plazo en el circuito cerebral del refuerzo, lo cual explica que la búsqueda de esas sustancias y el deseo de consumirlas continúen persis-tiendo aún transcurrido un largo periodo. En el caso de los psicoestimulantes, como la cocaína, el retiro de esta droga va asociado a una disminución de las transmisio-nes de dopamina y serotonina en el núcleo Acumbens (Ambrosio-Flores y Fernández-Espejo, 2011).
Así pues, los estudios funcionales de neuroimagen in-dican que el consumo crónico de sustancias psicoactivas generan una disminución de transmisión dopaminérgica, que es duradera y que está asociada con la reducción de actividad metabólica en regiones cerebrales del lóbulo frontal (Ambrosio-Flores y Fernández-Espejo, 2011).
Susceptibilidad individual en los sistemas neuronales
Las acciones de las drogas en el cerebro se traducen en una modificación de la comunicación neural de las células nerviosas, lo que produce que las actividades placenteras de manera natural, importantes para la supervivencia hu-mana (comida, sexo, bebida, etcétera), no lleguen a tener tal prioridad como la droga (Martin-García et al., 2016).
Entonces con la droga el usuario queda sensibilizado y marcado; dicha sensibilización hace que el sujeto sea vul-nerable después de una abstinencia y ocasiona recaídas, ya sea por un consumo mínimo de drogas o un factor psicoso-cial (Ambrosio-Flores y Fernández-Espejo, 2011).
Por otro lado es necesario recordar que la conducta adictiva es una respuesta motora, lo que quiere decir que como todas las respuestas de este tipo, iniciada por el área motora suplementaria y coordinada por los ganglios basales y el cerebelo, son fundamentales para el apren-dizaje de respuestas motoras, por lo que al igual que un ser humano que ha aprendido a montar en bicicleta es capaz de desarrollar una respuesta motora de pedaleo al sentarlo, un adicto a sustancias es capaz de desarrollar una respuesta aprendida de consumo en un ambiente de-terminado. Dicha respuesta condiciona un factor añadi-do que favorece la aparición de la conducta adictiva; las estereotipas motoras inducen sistemas de activación de respuestas automáticas a nivel motivacional y cognitivo (Ambrosio-Flores y Fernández-Espejo, 2011).
Así pues, por todo lo mencionado de la neurobiología de las adicciones muestra que las sustancias que generan adicción afectan en la morfología neuronal y en lo bioquí-mico y neuroquímico de la transmisión sináptica, por lo que la plasticidad neuronal está alterada, lo que afecta de ma-nera significativa en el aprendizaje, funciones ejecutivas y memoria (Ambrosio-Flores y Fernández-Espejo, 2011).
Nacimiento de nuevos modelos neuropsicológicos acerca de la adicción
Modelo de sensibilización al incentivo de Robinson y Berridge (2008).
Como se mencionó, el modelo clásico de la adicción apuntaba al “circuito de recompensa o del placer” que dentro de la neuroanatomía comprometía al circuito do-paminérgico mesolímbico. Fue de ahí que nacieron los modelos hedónicos, donde las drogas eran reforzadores potentes y por tanto placenteras. Sin embargo se demos-tró que el consumo compulsivo de drogas estaba rela-cionado con un mecanismo motivacional no hedónico (Robinson y Berridge, 2008).
Esto quiere decir que las drogas adquieren la capa-cidad de hiperactivar los sistemas motivacionales inclu-so si hay ausencia de efectos placenteros, por lo que los drogodependientes aún quieren consumir drogas por más de que no exista un gusto por tomarlas. Es así que nue-vos modelos neuropsicológicos nacen de este modelo de sensibilización al incentivo (Verdejo y Tirapu, 2011).
El modelo de sensibilización al incentivo plantea que el abuso de las drogas genera neuroadaptaciones persistentes en las neuronas y circuitos cerebrales, te-niendo como resultado la hipersensibilización del cir-cuito a los estímulos relacionados con las drogas de consumo (Robinson y Berridge, 2008).
Es decir, que existe una sensibilización del valor de las situaciones asociadas al consumo de cocaína pro-duciendo el deseo compulsivo. El sujeto presta mayor atención a la situación que antecede su consumo, lle-gando a tener una motivación patológica por su consu- mo (craving). Es así que las señales que anteceden a la sustancia son asociadas a su consumo, ocurriendo un condicionamiento pavloviano, ocasionando un estímu-lo condicionado (EC) que genere el consumo automáti-co (Kringelbach y Berridge, 2015).
De esta manera los contextos ambientales asociados con el consumo llevarán a un nuevo contacto con la droga, lo que amplifica los niveles de sensibilización al incentivo, lo que permite que el ambiente lleve al sujeto al deseo irresisti-ble por consumir repetidas veces (Robinson et al., 2015).
Sin embargo, por el circuito dopaminérgico explica-do la cocaína no tiene el mismo efecto en el individuo, por lo que hay un enorme deseo, pero un efecto poco pla-centero, presentándose una disociación entre los efectos de placer o displacer producidos por las drogas, denomi-nados liking, y los efectos asociados a la valoración moti-vacional generada por las drogas, denominados wanting. Se considera que conforme avanza el proceso adictivo los efectos liking se reducen de manera proporcional al incremento de los efectos wanting, por lo que existe una hipersensibilización motivacional, por más que la droga ya no cause placer, y está es regida por un contexto, un ambiente que hace que despierte en el individuo deseos por la droga (Robinson y Berridge, 2008).
De acuerdo con este modelo, dentro del sustrato neu-roanatómico está comprometido el núcleo Acumbens, que recibe proyecciones fásicas dopaminérgicas, mediadas por receptores D2, desde el área tegmental ventral y el hipo-campo, y se proyecta hacia la corteza prefrontal, sobre todo hacia el cíngulo anterior (Robinson y Berridge, 2008).
Por otro lado, uno de los últimos aportes de la neu-ropsicología es que en un sujeto adicto a la cocaína hay un gran compromiso de la corteza prefrontal, la región cerebral responsable de las funciones ejecutivas, que contribuye a distintos aspectos del proceso adictivo, in-cluyendo la vulnerabilidad, la dependencia y las recaí-das o craving (Verdejo y Tirapu, 2011).
Modelo neuroevolutivo
Parte del conocimiento de la maduración cerebral obte-nido mediante estudios longitudinales de neuroimagen, plantea que durante la adolescencia se produce un des-equilibrio en el nivel de maduración cerebral, compro-metiendo áreas del procesamiento de recompensa, el núcleo estriado y sus proyecciones dopaminérgicas, y estructuras implicadas en la regulación de la conducta, además de la corteza prefrontal (Ernst y Fudge, 2009).
Esto es, en la adolescencia ocurre un desequilibrio biológico entre la temprana maduración del núcleo es-triado, con proyecciones excitatorias, y la corteza pre-frontal, con proyecciones inhibitorias; conlleva en la persona dificultades para controlar las conductas mo-tivadas por recompensas inmediatas, convirtiendo a los adolescentes en puntos vulnerables ante los efectos re-forzantes de las drogas. A este desequilibrio contribuye la relativa inmadurez de las conexiones entre la corteza prefrontal-cingulada y la amígdala, la cual es clave para el desarrollo de las capacidades de anticipación de con-secuencias negativas y para una regulación del afecto negativo (Ernst y Fudge, 2009).
Es por eso que dentro de este modelo evolutivo la edad es muy importante porque si se retrasa el inicio de consumo, el cerebro estará más desarrollado, con más capacidad de autocontrol, de inhibir conductas desadaptativas, de unir el conocimiento de las conse-cuencias del consumo con las emociones que genera la visualización de dichas consecuencias a largo plazo, y de empatizar y valorar, desde una perspectiva no sólo cognitiva sino emocional (Verdejo y Tirapu, 2011).
Modelo basado en la transición entre impulsividad y compulsión
Lo principal de este modelo es la transición de una fase ini-cial donde el consumo de drogas destaca por sus efectos reforzantes, a los que serían más vulnerables individuos con altos niveles de impulsividad premórbida, hacia una fase de dependencia donde existen conductas de consumo com-pulsivas que se mantienen a pesar de sus consecuencias ne-gativas (Belin, Mar, Dalley, Robbins y Everitt, 2008).
En resumen, el modelo plantea que las conduc-tas adictivas se inician por la búsqueda del placer para pasar de manera progresiva a la transformación de con-ductas cuyo objetivo es evitar el malestar, por lo que en la evaluación neuropsicológica es muy importante evaluar los distintos aspectos del eje de impulsividad y compulsión, incluyendo paradigmas de inhibición de respuesta, reflexión e impulsividad y reversión de apren-dizaje (Verdejo, Lawrence y Clark, 2008).
Además, se puede monitorear el proceso adictivo por medio de marcadores neuropsicológicos de com-pulsión e impulsividad, teniendo en cuenta que la di-ferencia es disminuir malestar y obtener placer respec-tivamente. Asimismo, se puede observar el progreso mediante neuroimagen, donde debería existir una me-jora entre las regiones anteriores y dorsales del núcleo estriado (Verdejo, Lawrence y Clark, 2008).
Modelo de alostasis y estrés de Koob y Le Moal (2001, 2008)
Este modelo plantea que la adicción es resultado de un cambio en el control de la conducta motivada, donde hay una transición de remplazo de los mecanismos de refor-zamiento positivo, es decir, la recompensa hedónica que conlleva el consumo de la sustancia por mecanismos de refuerzo negativo dirigidos para reducir el estrés y malestar que causa el síndrome de abstinencia, e intentar restablecer el equilibrio homeostático (alostasis) (González, 2015).
Según Koob y Le Moal (2001), dicha transición es pro-ducto de la desregulación progresiva de dos mecanismos: 1) la pérdida de función del sistema de recompensa, el cual manifiesta un incremento de umbrales de estimulación in-tentando tener un equilibrio homeostático de no malestar, y 2) la hiperactivación de los sistemas de estrés que pasan a dominar el balance motivacional del organismo.
Esto es, la combinación de no funcionalidad de los circuitos de recompensa y una hiperactivación de los mecanismos de estrés permite la existencia de un refor-zamiento negativo, en el cual el individuo ya no con-sume la droga para sentir placer sino para evitar sentir malestar (Koob y Le Moal, 2008).
Dentro del campo de la neuroanatomía está impli-cada la amígdala extendida hacia el sistema hipotalámi-co-pituitario-adrenal, así como el papel regulador de la corteza prefrontal y el giro cingulado en los sistemas de estrés, dejando en claro que la disfunción de dicha corteza disminuiría la capacidad del individuo para regular estados motivacionales de estrés y malestar (Asensio, 2011).
Así, el principal aporte de este modelo es en la eva-luación neuropsicológica al paciente drogodependien-te, en la cual se debe medir la experiencia emocional y la manera en que su estado afectivo repercute en sus funciones cognitivas superiores (Asensio, 2011).
Modelo del daño en la atribución de relevancia y la inhibición de respuesta (I-RISA)
Este modelo, planteado por Goldstein y Volkow (2002), manifiesta que la adicción es la alteración de dos siste-mas complementarios. El primero se refiere a que hay una valoración exagerada de las propiedades reforzan-tes de las drogas priorizando ante reforzadores natura-les, como el sexo, comida, bebida, etcétera. El segundo sistema alterado está relacionado con la inhibición del individuo por frenar conductas inapropiadas.
La combinación alterada de ambos sistemas se presenta de manera transversal durante el consumo de drogas, incluyendo consumos iniciales, intoxicación, craving o recaída, incluso después de periodos de absti-nencia prolongada (Asensio, 2011).
Por otro lado, dicha disfunción de sistemas implica un daño neuropsicológico en la memoria y condicio-namiento (que corresponde al hipocampo y amígdala), motivación y programación de respuesta motoras (que está relacionada con los ganglios basales), la inhibición de respuesta motora (que está relacionada con la corte-za cingulada) y la toma de decisiones (asociada con la corteza orbitofrontal) (Verdejo y Tirapu, 2011).
Modelo basado en la toma de decisiones
Este modelo plantea que la adicción está relacionada con la toma de decisiones, incluyendo mecanismos mo-tivacionales, emocionales, mnésicos y de selección de respuesta (Bausela-Herreras, 2012).
La toma de decisiones es muy importante porque existe una “miopía a futuro” por parte del consumidor, debido a que existe una toma de decisiones de manera impulsiva sin pensar en las repercusiones o consecuen-cias futuras de dichas decisiones (Redish, Jensen y Joh-noson, 2008).
Además, que la toma de decisiones es un proceso guiado por señales emocionales que anticipan los re-sultados potenciales de distintas opciones de decisión; dichos marcadores conllevan cambios endocrinos o neurofisiológicos y guía la toma de decisiones hacia respuestas adaptativas para el individuo siguiendo una lógica homeostática (Damasio, 1994).
En el ámbito de las adicciones el modelo indica que la adicción secuestra los sistemas motivacionales y emocionales, priorizando las señales emocionales de sentimiento de urgencia por consumir, en cuyo procesa-miento interviene la ínsula, que es una región especia-lizada en el procesamiento interoceptivo, cuya lesión produce la interrupción drástica de la sensación de de-seo; además existe una baja selección de respuesta ha-cia opciones de reforzamiento inmediato, por lo que se promueven las decisiones con base en el reforzamiento inmediato, que vendría a ser el consumo, sin tener ma-yor flexibilidad; entonces hay una persistencia al error (Verdejo y Bechara, 2009).
En cuanto a estructuras cerebrales, intervienen la cor-teza orbitoforntal y amígdala, que está relacionado con los marcadores emocionales; la lectura que se hace de estos marcadores corresponde a la ínsula y corteza somatosen-sorial, y por último la selección de respuesta, por el núcleo estriado y la corteza cingulada anterior (Soria, 2006).
Además, en la neurociencia y la neuropsicología la voluntad tiene una importancia significativa y está rela-cionada con la toma de decisiones; si uno genera imáge-nes de las consecuencias de consumir drogas a corto plazo y éstas son de euforia, y a la vez crea imágenes de los efectos de la droga a largo plazo que vendrían a ser miedo o tristeza, vencerán las consecuencias a corto plazo. Esto es clave para comprender el comportamiento de las personas adictas, siendo incluso un factor de vulnerabilidad al consumo que afecta al sistema complejo y sensible. La parte estructural cerebral encargada de la yuxtaposición de imágenes y emociones es el sector ventromediano del córtex prefrontal (Verdejo y Bechara, 2009).
Modelo somático en las drogodependencias
Una de las preguntas más frecuentes respecto a los con-sumidores de drogas es acerca de la razón por la que estos individuos son tan insensibles a las consecuencias futuras del consumo y por qué tienen tanta dificultad para elegir las opciones correctas; esto está asociado —como ya se indicó— con la miopía a futuro (Verdejo, 2006) (figura 1).
El modelo del marcador somático manifiesta que una vez que la droga está expuesta a los ojos del consu-midor, se activa la amígdala y la corteza prefrontal ven-tromedial, la cual se encarga de procesos autorreflexi-vos; de inmediato se envían señales relacionadas con la expectativa de consumo. Dichas señales generan una intensa activación corporal que tiene la capacidad de hiperactivar los mecanismos motivacionales (ganglios basales) y de selección de respuesta (corteza cingulada anterior), propiciando una toma de decisiones basada en la satisfacción de la necesidad inmediata. Las con-ductas de consumo retroalimentan este círculo vicioso (Valladares y Bailén, 2011).
En este modelo se propone que la toma de decisio-nes es un proceso guiado por señales emocionales rela-cionado con la homeostasis, las emociones y sentimien-tos, donde hay una integración en procesos cognitivos, emocionales y neuroanatómicos para explicar el vínculo de las emociones con la toma de decisiones en función de las consecuencias futuras en lugar de las inmediatas. Entonces, en individuos drogodependientes existe un déficit en los mecanismos emocionales que anticipan los resultados prospectivos de una determinada acción, y orientan la selección de la respuesta más ventajosa; esto está asociado con un proceso de homeostasis y mo-dificaciones fisiológicas (Perera, 2013).
En este modelo los marcadores somáticos pueden generarse a partir de dos eventos: inductores primarios, que sería el encuentro con la droga, y los inductores secundarios, que son entidades generadas a partir de un recuerdo personal o hipotético de un evento emocional, en el caso del drogodependiente serían los recuerdos de episodios de consumo (Perera, 2013).
Una de las estructuras fundamentales es la amíg-dala, la cual envía señales al hipotálamo y al tronco en-cefálico, cuando se presentan los inductores primarios, para que después haya consolidación de un valor afec-tivo asociado al estímulo, donde se comprometen áreas cerebrales, como la ínsula y la corteza somato sensorial primaria y secundaria (Morandín-Ahuerma, 2019).
Por otro lado, la estructura fundamental para la generación de marcadores somáticos a partir de inductores secundarios es la corteza orbitofrontal. Es así que ambos inductores primarios aportan en la consolidación del comportamiento del consumidor, donde hay una disociación, y es posible que haya una valoración afectiva negativa de la sustancia por los efectos que ésta produce, pero por otro lado un incentivo por consumirla, lo cual es fundamental al tomar decisiones (Verdejo, 2006).
A esto están comprometidas las estructuras cerebra-les, el estriatum, que parece implicado en la modificación de la conducta mediante la influencia de marca-dores somáticos de manera implícita; es el caso de la toma de decisiones sin conciencia explícita, como en el drogodependiente al inicio de su consumo, no se da cuenta que está desarrollando un problema. Además, que la corteza cingulada anterior y el área motora suple-mentaria motora adyacente, relacionadas con la progra-mación de acción, estarían implicadas en la influencia explicita de dichos marcadores, por lo que estas áreas están relacionadas con el craving (Del Rocío-Márquez, Alcañiz, Quesada y Bailén, 2013).
Asimismo, a nivel de pensamiento o recuerdos, donde intervienen los procesos cognitivos, están la cor-teza orbitoforntal lateral y la prefrontal dorsolateral, y existe la potenciación de determinadas opciones y re-chazar otras antes de que dichas opciones se traduzcan en cursos de acción (Verdejo et al., 2007) (figura 2).
Varias investigaciones indican que la influencia de los marcadores somáticos está mediada por la producción de determinados neurotransmisores, dopami-na, serotonina, noradrenalina y acetilcolina, donde los cuerpos celulares de éstos están ubicados en el tronco-cerebral y sus terminales axonales se proyectan en múltiples regiones corticales. Por tanto, esto puede modular la actividad sináptica de grupos de neuronas implicadas en procesos de control cognitivo y ejecución de la conducta, por lo que esta cadena de mecanismos es im-portante vía donde los marcadores somáticos modifican cogniciones y conductas, tal como se muestra en la figura 2 (Verdejo et al., 2014) (figura 3).
Evaluación de las alteraciones neuropsicológicas relacionadas con el consumo de drogas
Durante la última década, por medio de la investigación neuropsicológica se demostró la determinación de las características del deterioro cognitivo asociado con el consumo de drogas. Con este objetivo se establecieron tres premisas básicas; la primera fue la neuropsicología y las entrevistas de consumo de drogas. Elija una herra-mienta de evaluación de acuerdo con la situación espe-cífica de la adicción y explique por qué debe tenerse en cuenta la importancia funcional del déficit (Ruiz Sán-chez de León et al., 2011).
Entonces la selección de instrumentos debe estar guiada por objetivos que determinen los perfiles de consu-mo y severidad. De acuerdo con algunos estudios los po-liconsumidores con uso de cocaína han demostrado que los instrumentos de evaluación de las funciones ejecutivas y en particular las pruebas de fluidez fonológica (FAS), me-moria de trabajo (letras y números), inhibición de respuesta (stroop), flexibilidad (prueba de categorías) y planificación (mapa del zoo) permiten discriminar de modo adecuado entre consumidores de drogas y no consumidores, además de tener la posibilidad de determinar entre distintos per-files de consumidores, como es el caso de los consumi-dores de cocaína que presentan mayores alteraciones en los dominios de inhibición y flexibilidad, mientras que los consumidores de heroína presentan mayores alteraciones relacionadas con la planificación (Fernández-Serrano, Lo-zano, Pérez-García y Verdejo-García, 2010).
Varios estudios han demostrado que las habilidades de autorregulación y flexibilidad son clave para la re-tención y la adherencia al tratamiento. Los instrumentos como la “Prueba de categorías”, el “Test de clasificación de tarjetas de Wisconsin” o el “Test de aplicación de es-trategias” pueden contribuir a identificar a las personas en riesgo de abandono terapéutico (Verdejo, 2015).
Así como en el caso de la recaída, estudios demuestran que los tests de toma de decisiones, como el Iowa Gambling Task, que implican posibles recompensas en un contexto de incertidumbre y riesgo, predicen de manera significativa la posibilidad de recaer (Verdejo et al., 2014).
En la tabla 1 de Verdejo (2016) se muestra la clasi-ficación y descripción de medidas neuropsicológicas de funcionamiento ejecutivo habitualmente utilizadas en consumidores de drogas (tabla 1).
Alteraciones neuropsicológicas causada por la cocaína
Daño cerebral y a nivel del sistema de neurotransmisores
El consumo de cocaína altera de manera progresiva el equilibrio de los neurotransmisores y los neurorrecepto-res, con lo que produce cambios y neuroadaptaciones moleculares en los diferentes sistemas, por lo que genera una disfunción en los sistemas afectados (Madoz-Gúrpide, Ochoa-Mangado y Martínez-Pelegrín, 2009).
La cocaína está muy relacionada con el sistema dopaminérgico, es especial las vías situadas en el lóbulo frontal, siendo un potente inhibidor de dopamina al unirse con la proteína transportadora, es decir, desempeña en el cerebro la función de bloquear los transportadores de monoaminas, inhibiendo la recaptación de dopamina, serotonina y norepinefrina, causando deterioros neuropsicológicos, consecuencia de la sobreestimulación de las vías dopaminérgicas y la consecuente hipoactivación o el agotamiento de estas vías una vez abandonado el producto (Martín, 2003).
Es necesario recordar que los circuitos dopaminér-gicos frontales median los aspectos cognitivos, motores y emocionales de la conducta humana. La afección de cada uno de ellos conlleva una alteración funcional determina-da. Así, el circuito cingular anterior está implicado en la motivación y el mantenimiento de la atención; el circuito frontal dorsolateral lesionado produce el síndrome diseje-cutivo, y la del circuito motor genera enlentecimiento mo-tor. El circuito oculomotor se relaciona con alteraciones en la búsqueda visual, y la afectación del circuito frontal orbitolateral se manifiesta en la incapacidad para el con-trol de los impulsos y desajuste social (Madoz-Gúrpide, Ochoa-Mangado y Martínez-Pelegrín, 2009).
Asimismo, se han señalado efectos del consumo de cocaína en los sistemas serotoninérgico, noradrenér-gicos, GABAérgicos, opioides y glutamatérgicos, que a su vez pueden revertir en alteraciones del sistema do-paminérgico por las acciones modulatorias que en éste ejercen dichos sistemas (Méndez-Díaz et al., 2017).
Por otro lado, estudios revelan que hay una afección en las estructuras corticales, así como la relación que tienen estas áreas cerebrales con las funciones cognitivas. Las áreas comprometidas en el consumo de cocaína son el lóbulo pre-frontal, la corteza dorsolateral y la corteza paralímpica.
El lóbulo prefrontal desempeña una función muy importante en relación con las funciones ejecutivas; dentro de éste, la corteza orbitofrontal media en los efectos de recompensa de la cocaína, así como en la toma de decisiones y comportamientos compulsivos, mediante el control inhibitorio que elimina los estímu-los irrelevantes (Lázaro y Solís, 2008).
La corteza dorsolateral integra la información sen-sorial con la procedente del sistema límbico y el córtex paralímbico, cuya función es integrar las emociones con las sensaciones. Es esencial para la organización tempo-ral de las acciones dirigidas hacia una meta, incluyen-do entre otras funciones relacionadas la planificación, la conceptualización y categorización, la memoria de trabajo y la resolución de problemas.
La corteza paralímpica aporta el elemento motiva-cional a la acción, por lo que el consumo de cocaína genera daños cerebrales que lógicamente tiene como consecuencia problemas en las funciones cognitivas (Méndez-Díaz et al., 2017).
Daño a nivel de funciones cognitivas
Diversos estudios manifiestan que existe un detrimento delimitado en las alteraciones cognitivas en consumi-dores crónicos de cocaína; el perfil se caracteriza por deterioro en procesos de atención, sobre todo atención selectiva y concentración, memoria verbal y visual, habi-lidades de abstracción y flexibilidad mental; sin embargo, se demostró que la abstinencia de la sustancia puede ge-nerar que dichos procesos mejoren, siempre y cuando los consumidores sean fiel sólo a la cocaína, porque si habla-mos de policonsumidores, o de personas que además de cocaína consumen alcohol, los resultados no muestran una mejora significativa (Verdejo, 2016).
Por otro lado, uno de los componentes dentro de las funciones ejecutivas más deteriorado ante el consumo de cocaína es el de inhibición de respuesta, mostrando alteraciones para inhibir respuestas motoras y en tareas de interferencia atencional o impulsividad perceptiva, teniendo como consecuencia la incapacidad de contro-lar pensamientos e imágenes recurrentes relacionadas con la droga (Mariño, Castro y Torrado, 2012).
Asimismo, existe una disfunción en la toma de de-cisiones, teniendo como resultado la elección de opcio-nes arriesgadas en tareas explicitas de decisión asociada al riesgo (Leland y Paulus, 2005).
Es así que existen disfunciones, en especial ejecu-tivas, dentro del consumo crónico de cocaína; se han establecido relaciones explicativas entre la impulsivi-dad, la tendencia a la perseveración y la incapacidad de aprendizaje de los errores con la recaída en el consumo, y se ha propuesto que las alteraciones neuropsicológicas serían un buen criterio predictor de riesgo (Madoz-Gúr-pide Ochoa-Mangado y Martínez-Pelegrín, 2009).
Daño a nivel emocional
Modelo de déficit en la atribución de relevancia a inhibición de respuesta (I-RISA)
El modelo propone que la adicción es resultado de dos sistemas complementarios: un sistema motivacio-nal-emocional, que daría una valoración exagerada de las propiedades reforzantes de las drogas, devaluando el de otros reforzadores naturales, y el sistema de in-hibición de respuestas automatizadas o guiadas por la recompensa, donde se cancelan conductas inadecuadas para las demandas del organismo, ocasionando la im-posibilidad de inhibir la conducta motivacionalmente marcada (Fernández, Rodríguez y Villa, 2011).
El daño en estos dos sistemas se evidencia en una disfunción de los circuitos cerebrales encargados de los procesos de memoria y condicionamiento, que corresponden al hipocampo y la amígdala, la motivación y programación de respuestas motoras cuya estructura son los ganglios basales, la inhibición de respuestas en que interviene el cín-gulo anterior, y la toma de decisiones que proviene de la corteza orbitofrontal. De este modo, en el “cerebro adicto” los sistemas de condicionamiento, aprendizaje y procesamiento de reforzadores estarían sensibilizados hacia estímulos asociados al consumo, mientras que el sistema de inhibición sería menos eficiente, facilitando las decisiones relacionadas con el consumo (Fernández, Chicharro, Ra-majo, Pérez, 2011) (figura 4).
Los sistemas encargados de la atribución de rele-vancia a los estímulos (sistemas de recompensa, con-dicionamientos implícitos y memorias explícitas) están hipersensibilizados hacia estímulos relacionados con el consumo, al tiempo que devalúan otros reforzadores na-turales. Los sistemas encargados del control de respues-tas impulsivas o guiadas por la recompensa inmediata están alterados, por lo que no pueden ejercer control en los resultados conductuales. Los procesos de toma de decisiones están sesgados por la hiperactivación de los sistemas que indican la necesidad de las drogas y la inoperancia de los sistemas de control, favoreciendo las conductas de consumo.
Modelo de vulnerabilidades
Redish, Jensen y Johnson (2008) han postulado distintas vías de vulnerabilidad que pueden sesgar el sistema de toma de decisiones hacia la selección de hábitos inflexi-bles, como la búsqueda de la sustancia en un drogode-pendiente. El modelo propone que el núcleo central de los cambios neuropsicológicos asociados con la adicción se produce en el equilibrio entre los sistemas de planificación y hábitos que hacen posible la toma de decisiones adapta-tiva. Este sistema es vulnerable a múltiples influencias que pueden sesgar la toma de decisiones hacia el consumo.
Las potenciales fuentes de vulnerabilidad pueden ser señales euforizantes de recompensa, el valor de premios a largo plazo se devalúa de modo exagerado, sobrevaloración de los sistemas de planificación, habitua-ción o desajuste entre ambos; estos sistemas pueden, de manera persistente, quedar sensibilizados a la búsqueda y la obtención de drogas (Redish, Jensen y Johnson, 2008) (figura 5).
De manera ilustrativa se muestran dos ejemplos que pueden afectar de modo más robusto al sistema de hábitos (como las alteraciones del equilibrio hedónico que hiperactivan los sistemas de estrés y reforzamiento negativo) o al sistema de planificación (como la depre-ciación de reforzadores demorados sesga al sistema de planificación hacia reforzadores inmediatos).
Respaldo de la neuroimagen en drogodependientes a la cocaína
La tecnología de neuroimagen es muy importante en el estudio de la adicción. En el estudio de la adicción hay algunas tecnologías estructurales que pueden informar la posición, forma y tamaño de algunas regiones del cerebro, y pueden cuantificar los cambios de volumen o densidad del tejido cerebral. Respecto a las materias gris y blanca, la tecnología funcional puede medir los cambios en la actividad cerebral, el metabolismo o los parámetros neurofarmacológicos (como la densidad del receptor o los niveles de neurotransmisores y metabolitos) (Fagundo et al., 2007).
Para visualizar y analizar la función cerebral en la adicción correspondiente se utilizaron dos situaciones experimentales diferentes: en el estado de reposo, cuan-do no se necesita activación cognitiva emocional, se usa para las sustancias y requisitos de la investigación aguda de administración de fármacos; cuando los sujetos participan de manera activa en el procesamiento de estímulos visuales o auditivos, o desarrollan tareas de rendimiento, es decir, para proporcionar a los usuarios de drogas es-timulación relacionada con el uso de drogas, se utiliza la activación nerviosa. El propósito de inducir el deseo y efectuar tareas cognitivas es comprender la eficiencia de los sustratos cerebrales (Fagundo et al., 2007).
Respecto a las técnicas estructurales, la más utiliza-da es la resonancia magnética estructural (RMe), que es la técnica de referencia en los estudios de drogodepen-dencias en los cambios volumétricos o de densidad de tejido (Fagundo et al., 2007).
Por otro lado, la técnica funcional más utilizada en los estudios de adicción es la resonancia magnética fun-cional (RMf); esta técnica se basa en la detección de las diferencias en la proporción de oxihemoglobina y desoxi-hemoglobina que se produce durante los estados de repo-so y activación cerebral, mediante un proceso conocido como efecto BOLD (Blood Oxigen Level Dependence), es decir, que cuando una zona cerebral es activada se produce a nivel fisiológico un incremento del flujo san-guíneo y del aporte de oxígeno superior a las necesidades metabólicas, lo que tiene como consecuencia un incre-mento de la oxihemoglobina (Fagundo et al., 2007).
Asimismo la tomografía por emisión de positro-nes (PET) y la tomografía por emisión de un único fotón (SPECT) permiten hacer estudios de metabolismo (PET) o de perfusión cerebral (SPECT) y estudios de neurotransmi-sión, aportando información bioquímica de los cambios en la actividad sináptica por medio del análisis de la den-sidad, distribución y grado de ocupación de receptores, enzimas y proteínas transportadoras, como receptores de dopamina D2, D3, monoaminoxidasa o transportador de serotonina (Denomme, Simard y Shane 2018).
Por último, la espectroscopia por resonancia mag-nética (ERME) permite determinar la distribución espacial de las concentraciones de diferentes metabolitos, como el N-acetilaspartato, la colina, el mionositol, la creatina o el lactato, donde la reducción del N-acetilaspartato es un correlato de daño neuronal y deterioro cognitivo, la colina está aumentada en alteraciones cerebrales que im-plican incremento de ruptura membranal, mielinización o inflamación, y se considera un reflejo de la densidad celular y el mionositol; por otra parte, es un marcador de pérdida glial; mientras que la creatina suele usarse como referente interno (Denomme, Simard y Shane, 2018).
Esto es, que la resonancia magnética por espec-troscopia permite visualizar presencia de determinadas moléculas que suelen aparecer en estados de lesión ce-rebral y representan un nuevo método para evaluar las lesiones inducidas por las sustancias psicotrópicas mu-cho antes de que se manifiesten en forma de alteracio-nes estructurales del cerebro, pero en paralelo con las sutiles alteraciones neuropsicológicas que ya se mues-tran desde las primeras etapas de consumo de determi-nadas sustancias, como los psicoestimulantes (Denom-me, Simard y Shane, 2018).
Administración aguda de cocaína
Una administración aguda de cocaína supone un incre-mento en el metabolismo tanto en áreas corticales, con predominio del lóbulo frontal, como en regiones subcorticales implicadas en el “circuito del refuerzo” que, como ya se indicó, corresponde al estriado, amígdala, hipocampo, tálamo o área tegmental ventral (Azadeh et al., 2016).
Así pues, la magnitud del cambio metabólico en la amígdala derecha parece seguir una correlación negati-va con lo agradable de su efecto y con la intensidad de la respuesta subjetiva. Por otro lado, la baja sensibilidad a los efectos euforizantes de la cocaína en los consu-midores que tienen los ventrículos agrandados, es una patología de las regiones periventriculares, en las cuales se encuentran las estructuras y los circuitos neuroanató-micos mediadores de dichos efectos reforzadores (De-nomme, Simard y Shane, 2018).
Estudios hechos con SPECT demostraron que hay un incremento de 40% del flujo sanguíneo regional en los ganglios basales y el córtex frontal después de la admi-nistración intravenosa de 40/48 mg de cocaína; por otro lado, en estudios efectuados con resonancia magnética funcional se han descrito además incrementos de la actividad cerebral en el núcleo estriado, el tálamo, la ínsula y el hipocampo después la administración de 0.6 mg/kg de cocaína; asimismo, dado que en dichos estudios los individuos pulsan un botón cada vez que quieren que se les administre la sustancia, aunque dicha administración se produce en intervalos fijos de cinco minutos, se han observado cambios de activación cerebral postinyección consistentes con incrementos de la activación en una am-plia red de estructuras frontobasales predominantemente lateralizadas en el hemisferio derecho, incluyendo el cór-tex orbitofrontal y cingulado, la ínsula, el núcleo estriado, y el tálamo o el cerebelo, por lo que esto está correlacio-nado con informes subjetivos del placer y craving que mostraron un importante solapamiento de las regiones mencionadas (Fagundo et al., 2007).
Respecto al BOLD, cuando se administraron 20 mg/70 kg se producía una señal en áreas del córtex pre-frontal anterior y orbitofrontal, y en regiones de los circui-tos dopaminérgicos mesolímbicos y mesocorticales, inclu-yendo el área tegmental ventral, el núcleo accumbens, el giro parahipocampal y la amígdala. Asimismo, la técnica del ERM también mostró un incremento de N-acetilaspar-tato (NAA) en el núcleo estriado (Fagundo et al., 2007).
Craving inducido por administración de cocaína
Estudios evidencian —después de la administración de cocaína— un incremento de oxigenación hemática ce-rebral (BOLD) en los núcleos accumbens, caudado y córtex insular, y una disminución de dicha oxigenación hemática cerebral en la amígdala; esto está correlacio-nado de modo positivo con un pico de activación y un rápido descenso a los niveles previos, y va en paralelo con la sensación subjetiva de euforia. Así pues, el cra-ving correlaciona de manera positiva con una activa-ción sostenida de las estructuras mencionadas (Denom-me, Simard y Shane, 2018).
Otros estudios mencionan también un incremento de la activación cerebral en el córtex prefrontal, el córtex tem-poral medial, la amígdala y el cerebelo, todas estas regio-nes encargadas de integrar los aspectos cognitivos y emo-cionales que permiten relacionar los estímulos ambientales con la sensación de craving (Fagundo et al., 2007).
Así, los estudios experimentales, al provocar a los consumidores utilizando videos de parafernalia relaciona-da con drogas y escenas de consumo, demostraron acti-vaciones del córtex frontal dorsolateral, orbitofrontal, cór-tex parietal, temporal medial y los ganglios basales en 13 consumidores de cocaína. En estos sujetos la respuesta de craving estaba significativamente asociada con cambios en la activación de la amígdala (Fagundo et al., 2007).
También los estudios hechos por medio de la téc-nica PET demostraron activaciones en estas mismas regiones, así como en otras áreas de los circuitos mo-tivacionales frontolímbicos, como la ínsula o el córtex cingulado anterior, por lo que se ha demostrado que el incremento de la actividad cerebral del córtex frontal, cingulado y temporal asociado al craving predice índi-ces clínicos de retención y recaída en consumidores de cocaína en tratamiento (Azadeh et al., 2016).
Alteraciones cerebrales
Alteraciones estructurales cerebrales
Por medio de la RMR es posible demostrar que los haces de fibras de materia gris y blanca tienen cambios en la morfología cerebral, lo que indica que la densidad de la materia gris en la corteza orbitofrontal, la corteza del plie-gue cingulado anterior se reduce de modo significativo, la isla, el lóbulo temporal y el cerebelo. Estas disminuciones en la densidad de la materia gris están relacionadas con cambios neuropsicológicos durante el movimiento men-tal y la ejecución (Azadeh et al., 2016).
Así, también estudios se enfocaron en estructuras es-pecificas comprometidas en el consumo de cocaínaN una de ellas es la amígdala, en la que se encontraron reduccio-nes de hasta 23% del volumen (Azadeh et al., 2016).
Otro estudio demostró que la existencia de reduccio-nes significativas de los haces de sustancia blanca que co-nectan el córtex prefrontal con la ínsula y otras estructuras subcorticales, indicando una disrupción de la conectividad en los circuitos fronto-límbicos (Fagundo et al., 2007).
Asimismo, el consumo crónico de cocaína se ha asociado con alteraciones en la integridad de la sustancia blanca a nivel del genu y la región rostral del cuerpo ca-lloso. En estas regiones el menor grado de mielinización, objetivado mediante la disminución de su anisotropía fraccional, correlacionó con un incremento de la impulsi-vidad y la falta de planificación. Otra región cerebral que parece afectarse después del consumo crónico de cocaí-na es el cerebelo, donde se han observado reducciones de la sustancia blanca que a su vez correlacionaron de modo negativo con el rendimiento psicomotor y las fun-ciones ejecutivas (Fagundo et al., 2007).
Alteraciones funcionales cerebrales
Tanto las alteraciones estructurales como las funcionales van de la mano en el caso de los drogodependientes; debido a que el consumo crónico de cocaína suele ir acompañado de cambios en el metabolismo o la actividad cerebral, entonces se produce una disminución metabólica preferentemente en regiones prefrontales, sugiriendo un patrón cortical específi-co en estos pacientes que podría relacionarse con la disfun-ción ejecutiva (Fagundo et al., 2007).
Por tanto, los consumidores de cocaína han reducido de manera significativa el metabolismo cerebral en las cor-tezas prefrontal y frontal lateral detectada por PET cuando el periodo de abstinencia de drogas es entre dos y seis sema-nas, pero se ha demostrado que es más eficaz en usuarios que han dejado la droga durante una semana porque tiene una alta activación (Denomme, Simard y Shane, 2018).
Por otro lado, para contrarrestar la hipótesis que se puede proponer en el párrafo anterior, los estudios he-chos con SPECT han demostrado que el metabolismo irrecuperable durante la abstinencia mejorará de mane-ra constante debido a los cambios significativos en el metabolismo de los lóbulos frontal, parietal y temporal de los consumidores con periodos prolongados de absti-nencia (Denomme, Simard y Shane, 2018).
Por último, estudios con ERM que han analizado las concentraciones de metabolitos específicos han revela-do disminuciones de las concentraciones de GABA en el córtex frontal, así como de NAA en el córtex prefrontal y regiones subcorticales, indicando un daño neuronal persistente asociado al consumo prolongado de cocaína (Denomme, Simard y Shane, 2018).
Cambios funcionales durante tareas cognitivas
Por todo lo indicado se puede decir que los cambios metabólicos en situación de reposo descritos en consu-midores crónicos de cocaína muestran alteraciones de la activación en regiones frontobasales durante el de-sarrollo de tareas de función ejecutiva, incluyendo pa-radigmas de inhibición (Stroop o Go/NoGo) y toma de decisiones (Fagundo et al., 2007).
Asimismo, utilizando como instrumento el Stroop en un diseño de PET se ha demostrado una reducción de la activación del córtex cingulado anterior y el córtex pre-frontal lateral que persiste incluso después 25 días de absti-nencia, por lo que se deduce que había una disfunción en la ejecución de tareas que requieren un esfuerzo cognitivo importante, pero en el caso específico del Stroop tendrían una función determinante en la inhibición de una respues-ta automatizada (Denomme, Simard y Shane, 2018).
Se demostró también que los cambios metabólicos en el cingulado anterior rostral y el córtex prefrontal la-teral correlacionó de manera negativa con el promedio de consumo semanal de cocaína; por tanto, el consumo crónico de cocaína podría causar alteraciones metabó-licas persistentes en los circuitos frontales que sustentan las funciones ejecutivas (Fagundo et al., 2007).
Por otro lado, mediante ensayos Go/No-Go, que requieren la inhibición de una respuesta motora predo-minante, se observó una reducción de la activación no sólo en el córtex cingulado anterior sino también en el área motora suplementaria y la ínsula, lo que sugería cambios funcionales no sólo en regiones corticales im-plicadas en las demandas cognitivas de la tarea, sino en otras que implican procesamiento emocional o motor (Fagundo et al., 2007).
Asimismo se evidenció que consumidores de cocaína abstinentes durante 25 días presentaban mayor activación del córtex orbitofrontal derecho y el núcleo estriado ventral, y una menor activación del córtex frontal medial y dorsolate-ral derecho durante la ejecución de la tarea. Estos resultados sugieren alteraciones metabólicas en regiones implicadas en la memoria de trabajo, la capacidad de anticipar los refuer-zos positivos y negativos, la planificación de las acciones y la toma de decisiones que a su vez está correlacionada con el número de gramos de cocaína consumidos por semana y la duración del consumo-vida de la sustancia, indicando una vez más cambios funcionales persistentes asociados a su uso crónico (Fagundo et al., 2007).
Otros estudios demuestran que los cocainómanos en tareas que implicaban el funcionamiento de la memoria operativa no mostraban activación de áreas prefrontales dorsolaterales ni del cingulado, y en cambio aumentaban la actividad en el cerebelo, lo que sugiere que en estos su-jetos las funciones de control cognitivo se han desplazado hacia regiones que proporcionan un peor rendimiento.
Para respaldar lo anterior, en la tabla 2 se muestran los paradigmas neuropsicológicos utilizados con técnicas de neuroimagen funcional en condiciones de activación.
Riesgo de complicaciones halladas con neuroimagen según la cocaína
La cocaína es una sustancia relacionada con accidentes cerebrovasculares hemorrágicos; los infartos relacionados suelen ser en las áreas de las grandes arterias, sobre todo en la arteria cerebral media, y en menor medida de la cerebral posterior; también se pueden observar en zonas subcorticales e hipocampo; además el riesgo general de accidente cerebrovascular isquémico es mayor casi siete veces más en relación con otras drogas de abuso (Verdejo y Tirapu, 2011) (tabla 3 y figura 6).
En 50% de los casos las hemorragias secundarias a cocaína se asocian con patología de base como malfor-maciones arteriovenosas o aneurismas. Las hemorragias cerebrales secundarias a cocaína pueden ser subarac-noideas o intraparenquimatosas; estas últimas suelen ser de localización subcortical y con frecuencia abiertas a los ventrículos tal como se muestra en la figura 6 (Mar-tinSchild et al., 2010)(figura 6).Además, la cocaína se asocia a la atrofia cerebral, donde se puede apreciar como un incremento en el tamaño de los ventrículos y de las cisuras. La atrofia es más intensa a nivel frontal y temporal. En los estudios de morfometría se objetiva una reducción de sustancia gris del córtex orbitofrontal ventromedial y lateral, cingulado anterior, insular anteroventral y temporal superior; no parece haber reducción en la densidad de la sustancia blanca (Verdejo y Tirapu, 2011).
Conjuntamente otra de las complicaciones son los vasoespasmos directo, es decir, la contracción de un vaso sanguíneo como respuesta a un estímulo, esto de-bido a que la cocaína genera un aumento plaquetario, pudiendo causar además infarto de miocardio y cerebral de trombosis subyacente, esto se puede observar me-diante técnicas de neuroimagen, donde por medio de resonancia magnética y angiografía se puede detectar (Tamrazi y Almast, 2012) (figura 7).
Por otro lado, informes de autopsia han demostrado la aterosclerosis acelerada, lo cual puede causar eventos isquémicos, tanto miocárdicos como cerebrales. Efectos de la cocaína en el endotelio vascular implica una dis-minución del óxido nitroso endotelial, producción de leucocitos, permitiendo la penetración de lipoproteínas de baja densidad en el espacio subintimal (pared de la arteria) (Tamrazi y Almast, 2012).
Asimismo, debido a que el consumo de cocaína agudo produce presión arterial rápida, puede generar la formación de aneurismas, es decir, dilatación anormal de las paredes de una arteria o una vena, y esto puede tener como consecuencia hemorragias, produciendo un accidente cerebrovascular hemorrágico (Tamrazi y Al-mast, 2012) (figura 9).
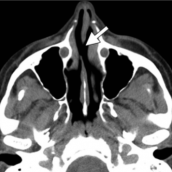
Fuera de los cambios neurológicos, el contacto fre-cuente y repetitivo de cocaína causa la destrucción y perfo-ración del tabique medio nasal, las coanas, las paredes de los senos paranasales y la bóveda palatina (Padilla-Rosas, Jiménez-Santos y García-González, 2006) (figura 10).
Recuperación de la adicción desde una perspectiva neurológica y neuropsicológica
Hoy se tienen datos que permiten afirmar que la recu-peración de los adictos no sólo es posible, sino que es la vía más probable de evolución de la adicción desde una perspectiva neurológica y neuropsicológica, oorque se puede afirmar que de modo consistente se encuentra que las alteraciones cerebrales estructurales y funciona-les vinculadas al proceso adictivo comienzan a remitir y normalizarse desde estadios muy tempranos de la absti-nencia (Pedredo et al., 2011).
Todos los estudios coinciden en admitir que las per-sonas que no son capaces de recuperarse de su adicción por sus propios medios y requieren de un tratamiento para conseguirlo presentan, al inicio de ésta, más cri-terios de gravedad de la adicción, peores condiciones sociales y más trastornos psicopatológicos concurrentes; por ende la perspectiva que proporciona un encuadre clínico puede llegar a hacernos creer que el proceso de abandono de una adicción es inevitablemente largo e inestable (Pedredo et al., 2011).
Sin embargo, mediante un distanciamiento y un en-foque científico libre de sesgos puede afirmarse que un considerable número de personas interrumpen su con-sumo sin ayuda profesional de ningún tipo; otros desa-rrollan patrones severos de consumo con importantes consecuencias o muestran una remisión espontánea, in-cluso de patrones graves de dependencia sin tratamien-to o después de una breve intervención profesional o un simple apoyo social no terapéutico, y también los hay que no cambian nunca a pesar de recibir tratamientos intensivos (Pedredo et al., 2011).
Por tanto, desde la perspectiva de la neurociencia se puede evidenciar de manera empírica de alteraciones estructurales, metabólicas y vasculares, que pueden es-tar relacionadas con los sustratos biológicos de la adic-ción. Sin embargo, los déficit y las vías implicadas en la adicción a sustancias son de modo esencial las mismas que participan en adicciones sin sustancias, pero tam-bién en otras manifestaciones comportamentales, como el enamoramiento romántico, el apego parental y el se-xual, entre otras (Hernandez-Reyes, Hernández-Castro, Águila-Gutiérrez y Hernández-Fleites, 2019).
Es de especial interés el amplio espectro de áreas cerebrales compartidas, así como alteraciones emocionales, cognitivas y comportamentales, entre la adicción y el enamoramiento romántico, en el que también está comprometido el funcionamiento de la ínsula, lóbulo parietal superior, sustancia gris periacueductal, globo pálido, núcleo caudado, área tegmental ventral y córtex cingulado, entre otras. De manera reciente, algunos autores proponen que las vías que regulan los estados emocionales asociados al craving en la cocaína son los mismos que regulan las emociones negativas vinculadas con el rechazo amoroso (Soto, Allauca y Allauca, 2017).
DISCUSIÓN Y CONCLUSIÓN
El consumo de drogas ilegales es estudiado últimamente desde el campo de la neuropsicología y neuroimagen, con el propósito de ofrecer información fidedigna y ad-vertir las consecuencias de los daños a nivel cerebral, cognitivo, emocional y estructural.
Así, los daños neuropsicológicos también se evi-dencian en el comportamiento repetitivo de consumo, su insensibilidad a las consecuencias futuras del consu-mo y porque tienen tanta dificultad para elegir las op-ciones correctas; esto está relacionado con la miopía a futuro.
Enfocándose en la cocaína, siendo ésta un estimu-lante de mucho comercio en el mundo, a pesar de ser ilegal, produce grandes daños estructurales y funciona-les en el cerebro, así como repercute en el comporta-miento del consumidor en momentos de craving o re-caídas, todo esto se evidencia por medio de técnicas de neuroimagen.
Sin embargo, respecto a la rehabilitación se mani-fiesta que la adicción es reversible, y la abstinencia en el caso de cocaína desempeña un papel esencial en éste, porque la plasticidad cerebral apoya al funcionamien-to de áreas cerebrales, propiciando una recuperación a largo plazo. La limitante de esto es la recaída del dro-godependiente en momentos de craving y abstinencia, por lo que se sugiere que la adicción es el producto de un desequilibrio en la interacción de dos sistemas neu-rales implicados en la toma de decisiones: un sistema impulsivo, la amígdala para señalar el dolor o el placer como perspectivas inmediatas, la corteza prefrontal para la señalización de las consecuencias a largo plazo, y cuya alteración se traduce en una pérdida del control de la voluntad. Esta formulación pone en duda la idea de adicción como enfermedad cerebral, salvo que sea tam-bién considerada como tal el enamoramiento, teniendo en cuenta el amplio paralelismo entre ambos (Pedredo et al., 2011).
Es así que, según la neurociencia, la adicción es reversible con un tratamiento, ya sea de manera con-ductual o por voluntad propia del consumidor, teniendo como factor en énfasis la constatación de que el entre-namiento de nuevas tareas produce cambios estructu-rales en el cerebro, hasta en periodos tan breves como sólo cinco días de trabajo e incluso la modificación de receptores dopaminérgicos en el córtex cerebral indu-cidos por el entrenamiento cognitivo después de cinco semanas, 35 minutos diarios. Además, el conocimiento de los mecanismos de plasticidad neuronal durante el proceso de recuperación después un daño cerebral y los correlatos conductuales de la recuperación funciona (Pedredo et al., 2011).
Con la información recolectada es necesario cues-tionar si las personas drogodependientes, o las que sólo consumen drogas en determinadas ocasiones, tienen conocimiento del daño cerebral que se causan a sí mis-mos, es decir, ¿las campañas contra las drogas son en realidad efectivas si no se ofrece la información ade-cuada y necesaria? La mayoría de los jóvenes están más preocupados por no mantener una conducta repetitiva en el consumo de drogas que de los daños que causa una sola dosis de cocaína en el cerebro, tanto a nivel cognitivo, emocional y ejecutivo. Es por ello que la in-formación científica, respaldada con pruebas de neu-roimagen, puede producir un shock más grande en los consumidores.
REFERENCIAS
Ahmed, S. H., & Koob, G. F. (1998). Transition from moderate to excessive drug intake: Change in hedonic set point. Science, 282, 298-300.
Ahmed, S. H., Walker, J. R., & Koob, G. F. (2000). Persistent increase in the motivation to take heroin in rats with a history of drug escalation. Neuropsychopharmacology, 22, 413-421.
Ambrosio-Flores, E., & Fernández-Espejo, E. (2011). Fundamentos neurobiológicos de las adicciones. En E. Pedrero (ed.). Neurociencia y adicción, pp. 19-46. Madrid: Sociedad Española de Toxicomanias.
Asensio, S. (2011). Bases neuroanatómicas y neurofuncionales del trastorno de abuso de alcohol y su relacion con la impulsividad. Estudio mediante resonancia Magnética. Tesis de grado. Valencia. España.
Ayala, S., Chicahual, B., Duffau, B., & Vargas, G. (2019). Cocaina base en Chile, 10 años de análisis. Revista del Instituto de Salud Pública de Chile, 3(2).
Azadeh, S., Hobbs, B. P., Ma, L., Nielsen, D. A., Moeller, F. G., & Baladandayuthapani, V. (2016). Integrative Bayesian analysis of neuroimaging-genetic data with application to cocaine dependence. NeuroImage, 125, 813-824.
Bausela-Herreras, E. (2012). Alteraciones en el funcionamiento ejecutivo en diferentes trastornos del desarrollo en la infancia y adolescencia. Archivo Neurociencias, 17(3), 179-187. Recuperado de http://www.medigraphic.com/pdfs/arcneu/ane-2012/ane123g.pdf.
Belin, D., Mar, A., Dalley, J., Robbins, T., & Everitt, B. (2008). High impulsivity predicts the switch to compulsive cocaine-taking. Science, 320(5881), 1352-1355.
Berridge, K. C. (2003). Pleasures of the brain. Brain and cognition, 52(1), 106-128.
Consejo Mexicano de Neurociencias (CMN) (2018). Obtenido de https://www.cosejomexicanodeneurociencias.org/.
Corominas, M., Roncero, C., Bruguera, E., & Casas, M. (2007). Sistema dopaminérgico y adicciones. Rev Neurol, 44(1), 23-31.
Damasio, A. R. (1994). El error de Descartes. Barcelona: Crítica Drakontos.
Del Rocío-Márquez, M., Alcañiz, M. P. S., Quesada, S. G. P., & Bailén, J. R. A. (2013). La hipótesis del Marcador Somático y su nivel de incidencia en el proceso de toma de decisiones. REMA, 18(1), 17-36.
Denomme, W. J., Simard, I., & Shane, M. S. (2018). Neuroimaging metrics of drug and food processing in cocaine-dependence, as a function of psychopathic traits and substance use severity. Frontiers in human neuroscience, 12, 350.
Di Ciano, P., Underwood, R. J., Hagan, J. J., & Everitt, B. J. (2003). Attenuation of cue-controlled cocaine-seeking by a selective D3 dopamine receptor antagonist SB-277011-A. Neuropsychopharmacology, 28, 329-338.
Ernst, M., & Fudge, J. L. (2009). A developmental neurobiological model of motivated behavior: Anatomy, connectivity and ontogeny of the triadic nodes. Neuroscience & Biobehavioral Reviews, 33, 367-382.
Everitt, B. J., & Robbins, T. W. (2016). Drug Addiction: Updating Actions to Habits to Compulsions Ten Years On. Annual review of psychology, 67, 23–50. https://doi.org/10.1146/annurev-psych-122414-033457
Fagundo, A. B., Martín-Santos, R., Abanades, S., Farré, M., & Verdejo-García, A. (2007). Neuroimagen y adicción I: Correlatos neuroanatómicos y funcionales de la administración aguda, el craving y el consumo crónico de psicoestimulantes. Revista Española de Drogodependencias, 32(4) 465-487.
Fernández, G. G., Rodríguez, O. G., & Villa, R. S. (2011). Neuropsicología y adicción a drogas. Papeles del Psicólogo, 2, 159-65.
Fernández, M. J., Chicharro, R., Ramajo, S., & Pérez, M. (2011). Alteraciones emocionales y su evaluación en adictos. Neurociencia y Adicción, pp. 163-186. Madrid: Sociedad Española de Toxicomanías.
Fernández-Serrano, M. J., Lozano, O., Perez-Garcia, M., & Verdejo-Garcia, A. (2010). Impact of severity of drug use on discrete emotions recognition in polysubstance abusers. Drug and Alcohol Dependence, in press.
García-Fernández, G., García-Rodríguez, O., Secades-Villa, R., Fernández-Hermida, J. R., & Sánchez-Hervás, E. (2010). Evolución de las funciones ejecutivas de adictos a la cocaína tras un año de tratamiento. Revista Española Drogodependencias, 35(2), 155-169.
Goldstein, R., & Volkow, N. (2002). Drug addiction and its underlying neurobiological basis: neuroimaging evidence for the involvement of the frontal cortex. Am J Psychiatry, 159, 1642-1652.
González, S. (2015). Estudio sobre población no consumidora y factores de protección percibidos. Tesis de pregrado. Universidad de la Laguna. Santa Cruz de Tenerife, España.
Hernández-Reyes, V. E., Hernández-Castro, V. H., Águila-Gutiérrez, Y., & Hernández-Fleites, X. (2019). El grupo de rehabilitación de adicciones en la prevención del alcoholismo desde centros escolares. Revista Médica Electrónica, 41(2), 508-521.
Kalivas, P. W., LaLumiere, R. T., Knackstedt, L., & Shen, H. (2009). Glutamate transmission in addiction. Neuropharmacology, 56, 169-173.
Koob, G. F., & Le Moal, M. (2001). Drug addiction, dysregulation of reward, and allostasis. Neuropsychopharmacology, 24(2), 97-129.
Koob, G. F., & Le Moal, M. (2008). Addiction and the brain antireward system. Annu. Rev. Psychol., 59, 29-53.
Kringelbach, M. L., & Berridge, K. C. (2015). Motivation and pleasurin the brain. En W. Hofmann & L. F. Jordgren (eds.). The Psychology of Desire, pp. 129-145. NY: Guilford Press.
Lázaro, J., & Solís, F. (2008). Neuropsicología de lóbulos frontales, funciones ejecutivas y conducta humana. Revista neuropsicología, neuropsiquiatría y neurociencias, 8(1), 47-58.
Leland, D., & Paulus, M. (2005). Increased risk-taking decision making but not altered response to punishment in simulant-using young adults. Drug and Alcohol Dependence, 78, 83-90.
Lorea, I., Fernández-Montalvo, J., Tirapu-Ustarroz, J., Landa, N., & López-Goñi, J. J. (2010). Rendimiento neuropsicológico en la adicción a la cocaína. Una revisión crítica. Revista Neurología, 51, 412-426.
Madoz-Gúrpide, A., & Ochoa-Mangado, E. (2012). Alteraciones de funciones cognitivas y ejecutivas en pacientes dependientes de cocaína: Estudio de casos y controles. Revista Neurología, 54, 199-208.
Madoz-Gúrpide, A., Ochoa-Mangado, E., & Martínez-Pelegrín, B. (2009). Consumo de cocaína y daño neuropsicológico. Implicaciones clínicas. Medicina Clínica, 132(14), 555-559.
Mariño, N., Castro, J., & Torrado, J. (2012). Funcionamiento ejecutivo en policonsumidores de sustancias psicoactivas. Revista de Psicología Universidad de Antioquia, 4(2), 49-63.
Martín-García, E., Bourgoin, L., Cathala, A., Kasanetz, F., Mondesir, M., Gutiérrez-Rodriguez, A., Reguero, L., Fiancette, J., Grandes, P., Spampinato, U., Maldonado, R., Piazza, V., Marsicano, G., & Deroche-Gamonet, V. (2016). Differential control of cocaine self-administration by GABAergic and glutamatergic CB1 cannabinoid receptors. Neuropsychopharmacology, 41(9), 2192-2205.
Martín-Sánchez, M. (2003). Estudio de los mecanismos neuronales implicados en las respuestas motivacionales de las drogas de abuso. Universitat Pompeu Fabra.
Martin-Schild, S., Albright, K. C., Hallevi, H., Barreto, A. D., Philip, M., Misra, V., & Savitz, S. I. (2010). Intracerebral hemorrhage in cocaine users. Stroke, 41, 680-684.
Méndez-Díaz, M., Romero-Torres, B. M., Cortés-Morelos, J., Ruíz-Contreras, A. E., & Prospéro-García, O. (2017). Neurobiología de las adicciones. Revista de la Facultad de Medicina UNAM, 60(1), 6-16.
Morandín-Ahuerma, F. (2019). La hipótesis del marcador somático y la neurobiología de las decisiones. Escritos de Psicología (internet), 12(1), 20-29.
Padilla-Rosas, M., Jiménez-Santos, C., & García-González, C. (2006). Perforación en bóveda palatina por consumo de cocaína. Medicina Oral, Patología Oral y Cirugía Bucal (internet), 11(3), 239-242.
Pedredo, E., Rojo, G., Ruiz, J. M., Llanero, M., García, G., & Puerta, C., (2011). Recuperación de la adicción, desde una perspectiva neurológica y neuropsicológica. Neurociencia y adicción, pp. 395-415. Madrid: Sociedad Española de Toxicomanías.
Perera, M. C. (2013). Toma de decisiones morales en drogodependencias: Aproximación neuropsicológica. Tesis doctoral, Universidad de Granada.
Redish, A. D., Jensen, S., & Johnson, A. (2008). A unified framework for addiction: Vulnerabilities in the decision process. Behavioral and Brain Sciences, 31, 415- 487.
Robinson, M., Burghardt, P., Patterson, C., Nobile, C., Akil, H., Watson, S., Berridge, K., & Ferrario, C. (2015). Individual differences in cue-induced motivation and striatal systems in rats susceptible to diet-inducedobesity. Neuropsychopharmacology, 40(9), 2113-2123.
Robinson, T. E., & Berridge, K. C. (2001). Incentive-sensitization and addiction. Addiction, 96(1), 103-114.
Robinson, T. E., & Berridge K. C. (2008). Review. The incentive sensitization theory of addiction: some current issues. Philosophical Transactions of the Royal Society B. Biological Sciences, 363(1507), 3137-3146.
Ruiz-Sánchez de León, J. M., Pedrero-Pérez, E. J., Rojo-Mota, G., Llanero-Luque, M., & Puerta-García, C. (2011). Propuesta de un protocolo para la evaluación neuropsicológica de las adicciones. Revista de neurología.
Soria, G. (2006). Sistemas cannabinoide y purinérgico: Posibles sustratos neurobiológicos de la drogadicción. Tesis doctoral. Barcelona. España.
Soto, R. M. S., Allauca, V. M. M., & Allauca, K. J. M. (2017). Terapia cognitiva-conductual para rehabilitación-reinserción social del adicto y minimización de factores biopsicosociales. Dominio de las Ciencias, 3(2), 752-769.
Tamrazi, B., & Almast, J. (2012). Your brain on drugs: Imaging of drug-related changes in the central nervous system. Radiographics, 32(3), 701-719.
Valladares, A. I. M., & Bailén, J. R. A. (2011). Toma de decisiones en pacientes drogodependientes. Adicciones, 23(4), 277-287.
Vazquez, M., & Ubach, M. (2018). El alcoholismo: Papel del receptor opioide en los procesos neurales de reforzamiento. Salud Mental, 24(5) 1-2.
Verdejo, A. (2006). Funciones ejecutivas y toma de decisiones en drogodependientes: Rendimiento neuropsicológico y funcionamiento cerebral. Universidad de Granada. España.
Verdejo, A. (2015). Neuropsicología: Cerebro y cocaína. Recuperado de: http://neurocienciayplasticidadcerebraluned.blogspot.com/2015/01/neuropsicologia-cerebro-y-cocaina.html.
Verdejo, A. (2016). Evaluación neuropsicológica en adicciones. Guía clínica [Neuropsychological assessment in addiction. A clinical guideline]. Acción Psicológica, 13(1), 1-6.
Verdejo, A., Aguilar de Arcos, F., & Pérez, M. (2004). Alteraciones de los procesos de toma de decisiones vinculados al córtex prefrontal ventromedial en pacientes drogodependientes. Revista Neurología, 38(7), 601-606.
Verdejo, A., Albein-Urios, N., Martínez-González, J. M., Civit, E., De la Torre, R., & Lozano, O. (2014). Decision-making impairment predicts 3-month hair-indexed cocaine relapse. Psychopharmacology, 231(21), 4179-4187.
Verdejo, A., & Bechara, A. (2009). A somatic marker theory of addiction. Neuropharmacology, 56(Suppl 1), S48-S62.
Verdejo, A., Lawrence, A. J., & Clark, L. (2008). Impulsivity as a vulnerability marker for substance use disorders: Review of findings from high-risk research, problem gamblers and genetic association studies. Neuroscience & Biobehavioral Reviews, 32, 777-810.
Verdejo, A., Pérez, M., Sánchez, M., Rodríguez, A., & Gómez, M. (2007). Neuroimagen y drogodependencias: Correlatos neuroanatómicos del consumo de cocaína, opiáceos, cannabis y éxtasis. Revista Neurología, 44(7), 432-439.
Verdejo, A., & Tirapu, J., (2011). Modelos neuropsicológicos de adicción. Neurociencia y adicción, pp. 47-66. Madrid: Sociedad Española de Toxicomanías.
Wikel, A. (1965). Conditioning factors in opiate addiction and relapse. En D. I. Wilner y G. G. Kassebaum (eds.). New York: McGraw-Hill.
| Cómo citar:APA6 |
Borda-Riveros, N. J. (2020). Modelos neuropsicologicos y neuroimagen de las alteraciones cerebrales ocasionadas por la cocaína. Revista Digital Internacional De Psicología Y Ciencia Social, 6(2), 452-478. https://doi.org/10.22402/j.rdipycs.unam.6.2.2020.243.452-478
|
























